Kesetimbangan kimial, kondisi dalam perjalanan reaksi kimia reversible(bolakbalik)
di mana tidak ada perubahan bentuk dan jumlah pada reaktan dan produk yang terjadi.
Reaksi kimia reversibel adalah satu di mana produk, segera setelah mereka
terbentuk, bereaksi kembali untuk menghasilkan reaktan asli atau bahan baku.
Pada kesetimbangan, dua reaksi akan saling berlawanan terus pada tingkat atau
kecepatan yang sama, maka tidak ada perubahan bentuk dan jumlah dalam zat yang
terlibat. Pada titik ini reaksi dapat dianggap akan selesai; yaitu, untuk
beberapa kondisi reaksi tertentu, konversi maksimum reaktan ke produk telah
dicapai.
Rumus Kesetimbangan Kimia
Kondisi yang berkaitan dengan keseimbangan dapat diberikan formulasi kuantitatif. Misalnya, untuk reaksi A reversibel ⇋ B + C, kecepatan reaksi ke kanan, r1, diberikan oleh ekspresi matematika (berdasarkan hukum aksi massa) r1 = k1 (A), di mana k1 adalah reaksi-laju konstan dan simbol dalam tanda kurung merupakan konsentrasi A. kecepatan reaksi ke kiri, r2, adalah r2 = k2 (B) (C). Pada kesetimbangan, r1 = r2, oleh karena itu: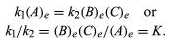
Huruf e mewakili kondisi pada kesetimbangan. Untuk reaksi
yang diberikan, pada beberapa kondisi tertentu suhu dan tekanan, rasio jumlah
produk dan reaktan hadir pada kesetimbangan, masing-masing dinaikkan menjadi
kekuatan masing-masing, adalah konstan, ditunjuk konstanta kesetimbangan reaksi
dan diwakili oleh simbol K. nilai konstanta kesetimbangan bervariasi dengan
suhu dan tekanan sesuai dengan prinsip Le Chatelier (lihat Le Chatelier,
Henry-Louis).
Dengan metode mekanika statistik dan termodinamika kimia,
dapat ditunjukkan bahwa konstanta kesetimbangan terkait dengan perubahan
kuantitas termodinamika disebut standar energi bebas Gibbs yang menyertai
reaksi. Standar energi bebas Gibbs dari reaksi ΔG°, yang merupakan perbedaan
antara jumlah dari energi bebas standar produk dan reaktan, sama dengan
logaritma natural negatif dari konstanta kesetimbangan dikalikan dengan apa
yang disebut konstanta gas R dan suhu T absolut:
Persamaan ini memungkinkan perhitungan konstanta
kesetimbangan, atau jumlah relatif produk dan reaktan hadir pada kesetimbangan,
dari diukur atau diturunkan nilai energi bebas standar zat.
Jadi, apa yang membuat Anda ingin mencari kesetimbangan
kimia?
