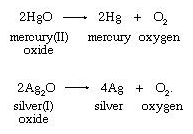Next page:
1
2
3
Oksigen (O), unsur kimia non logam dari Grup 16 (VIa, atau
kelompok oksigen) dari tabel periodik. Oksigen tidak berwarna, tidak berbau,
gas hambar yang penting untuk organisme hidup, diambil oleh hewan dan
mengubahnya menjadi karbon dioksida; tanaman menggunakan karbon dioksida dan mengembalikan
oksigen kembali ke atmosfer. Oksigen membentuk senyawa dengan bereaksi dengan
hampir semua unsur lainnya, dan juga oleh reaksi yang menggantikan unsur-unsur
dari kombinasi mereka satu sama lain; dalam banyak kasus, proses ini disertai
dengan produksi panas dan cahaya dan dalam kasus seperti ini disebut
combustions. Senyawa yang paling penting dari oksigen adalah air.
Sejarah Oksigen
Oksigen ditemukan sekitar tahun 1772 oleh seorang ahli kimia
Swedia, Carl Wilhelm Scheele, yang diperoleh dengan pemanasan kalium nitrat,
oksida merkuri, dan banyak zat lainnya. Seorang ahli kimia Inggris, Joseph
Priestley, secara independen menemukan oksigen pada tahun 1774 dengan
dekomposisi termal oksida merkuri dan mempublikasikan penemuannya pada tahun
yang sama, tiga tahun sebelum Scheele diterbitkan. Pada 1775-1780, ahli kimia
Perancis Antoine-Laurent Lavoisier, dengan wawasan yang luar biasa, menafsirkan
peran oksigen dalam respirasi serta pembakaran, membuang teori phlogiston, yang
telah digunakan sampai saat itu; ia mencatat kecenderungan oksigen untuk
membentuk asam dengan gabungan berbagai zat yang berbeda dan sesuai bernama
elemen oksigen (Oxygène) dari kata Yunani untuk "acid former."
Kejadian dan Sifat Oksigen
Iklan oleh Google
Oksigen adalah unsur yang paling berlimpah dalam kerak bumi.
Proporsi oksigen berdasarkan volume di atmosfer adalah 21 persen dan dalam air
laut adalah 89 persen. Dalam batuan, dikombinasikan dengan logam dan non logam
dalam bentuk oksida yang bersifat asam (seperti sulfur, karbon, aluminium, dan
fosfor) atau unsur dasar (seperti kalsium, magnesium, dan besi) dan senyawa
saltlike yang dapat dianggap sebagai bentuk dari oksida asam dan dasar, seperti
sulfat, karbonat, silikat, aluminat, dan fosfat. Senyawa oksigen padat tidak
berguna sebagai sumber oksigen, karena pemisahan unsur oksigen dari kombinasi
ketat dengan atom logam terlalu mahal.
Di bawah -183 ° C (-297 ° F), oksigen adalah cairan biru
pucat; menjadi padat pada sekitar -218 ° C (-361 ° F). Oksigen murni 1,1 kali
lebih berat daripada udara.
Selama respirasi, hewan dan beberapa bakteri mengambil
oksigen dari atmosfer dan mengembalikannya sebagai karbon dioksida, sedangkan
dengan fotosintesis, tumbuhan hijau menyerap karbon dioksida dengan adanya
sinar matahari dan melepaskan kembali ke udara sebagai oksigen. Hampir semua
oksigen bebas di atmosfer adalah hasil fotosintesis. Sekitar 3 bagian oksigen
larut dalam 100 bagian air tawar pada 20 ° C (68 ° F), dan lebih sedikit dalam
air laut. Oksigen terlarut sangat penting untuk respirasi ikan dan kehidupan
laut lainnya.
Oksigen alami adalah campuran dari tiga isotop stabil:
oksigen-16 (99,759 persen), oksigen-17 (0,037 persen), dan oksigen-18 (0,204
persen). Beberapa isotop radioaktif buatan yang diketahui. Yang memiliki umur
paruh yang panjang ialah oksigen 15 (124 detik paruh), telah digunakan untuk
mempelajari respirasi pada mamalia.
Alotropi Oksigen
Oksigen memiliki dua bentuk allotropic, diatomik (O2)
dan triatomik (O3, ozon). Sifat-sifat bentuk diatomik menunjukkan
bahwa enam elektron melakukan ikatan atom dan dua electron lainnya tetap tidak
berpasangan dihitung dari paramagnetisme oksigen. Tiga atom dalam molekul ozon
tidak tersusun dalam satu garis lurus.
Ozon dapat diproduksi dari oksigen menurut persamaan:
3O2 →
2O3
Oksigen Ozon
Proses, seperti yang tertulis, adalah endotermik (energi harus
disediakan untuk membuat reaksi terjadi); konversi ozon kembali menjadi oksigen
diatomik dipengaruhi oleh adanya logam transisi atau oksida mereka. Oksigen
murni sebagian berubah menjadi ozon oleh elektrik statis; Reaksi ini juga
disebabkan oleh penyerapan sinar ultraviolet yang panjang gelombangnya sekitar
250 nanometer (nm, nanometer, sama dengan 10-9 m); terjadinya proses ini di
bagian atas atmosfer menghilangkan radiasi yang akan berbahaya bagi kehidupan
di permukaan bumi. Bau menyengat ozon terasa di daerah di mana ada arus
listrik, seperti di ruang pembangkit listrik. Ozon berwarna biru muda;
densitasnya adalah 1,658 kali dari udara, dan memiliki titik didih -112 ° C
(-170 ° F) pada tekanan atmosfer.
Ozon adalah oksidator kuat, mampu mengkonversi sulfur
dioksida menjadi belerang trioksida, sulfida menjadi sulfat, iodide menjadi
yodium (menyediakan suatu metode analisis untuk estimasi), dan banyak senyawa
organik untuk oksigen derivatif seperti aldehida dan asam. Konversi ozon hidrokarbon
dari gas buang otomotif menjadi asam aldehida berkontribusi terhadap
terbentuknya asap yang menjengkelkan. Secara komersial, ozon telah digunakan
sebagai pereaksi kimia, sebagai desinfektan, dalam pengolahan limbah, pemurnian
air, dan pemutihan tekstil.
Metode Persiapan Oksigen
Metode produksi yang dipilih untuk oksigen tergantung pada
jumlah elemen yang diinginkan. Prosedur laboratorium adalah sebagai berikut:
1. dekomposisi termal dari garam tertentu, seperti kalium
klorat atau kalium nitrat:
Dekomposisi kalium klorat dikatalisis oleh oksida logam transisi;
mangan dioksida (pyrolusite, MnO2) sering digunakan. Suhu yang
diperlukan untuk mempengaruhi perubahan oksigen berkurang dari 400 ° C sampai
250 ° C dengan adanyan katalis.
2. Penguraian termal oksida logam berat:
Scheele dan Priestley menggunakan merkuri (II) oksida dalam
persiapan produksi oksigen.
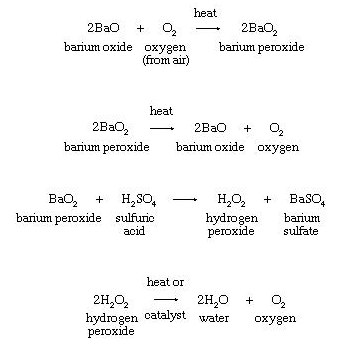
3. Penguraian termal peroksida logam atau hidrogen
peroksida:
Prosedur komersial awal untuk mengisolasi oksigen dari
atmosfer atau untuk pembuatan hidrogen peroksida tergantung pada pembentukan
barium peroksida dari oksida seperti yang ditunjukkan dalam persamaan.
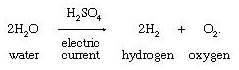
4. Elektrolisis air yang mengandung proporsi kecil garam
atau asam untuk memungkinkan konduksi arus listrik:
Bila diperlukan dalam jumlah tonase, oksigen disusun oleh distilasi fraksional dari udara cair. Komponen utama udara, oksigen memiliki titik didih tertinggi dan karena itu kurang stabil daripada nitrogen dan argon. Langkah-langkah utama dalam operasi ini sebagai berikut: (1) Air disaring untuk menghilangkan partikel; (2) moisture dan karbon dioksida dikeluarkan oleh penyerapan dalam alkali; (3) udara terkompresi dan kompresi panas dihapus oleh prosedur pendinginan biasa; (4) udara yang dikompresi dan didinginkan dilewatkan ke kumparan yang terdapat dalam sebuah ruangan; (5) sebagian dari udara terkompresi (sekitar tekanan 200 atmosfer) diperbolehkan untuk memperluas ruang pendingin kumparan; (6) gas yang diperluas dikembalikan ke kompresor dengan beberapa langkah ekspansi kompresi berikutnya sehingga akhirnya pada pencairan, udara terkompresi pada suhu -196 ° C; (7) udara cair dibiarkan hangat untuk menyaring gas mulia ringan pertama, nitrogen, dan meninggalkan oksigen cair. Beberapa fractionations akan menghasilkan produk yang cukup murni (99,5 persen) untuk keperluan industri.
Industri baja merupakan konsumen terbesar oksigen murni yang digunakan untuk "peniupan" karbon tinggi pada stainless. Yaitu karbon dioksida volatilizing dan kotoran bukan logam lainnya agar proses lebih cepat dan lebih mudah dikontrol daripada jika udara biasa digunakan. Perlakuan oksigen terhadap limbah merupakan reaksi yang efisien untuk mengolah limbah cair bila dibandingkan dengan proses kimia lainnya. Pembakaran limbah dalam sistem tertutup menggunakan oksigen murni telah menjadi penting. Yang disebut LOX oksigen cair bahan bakar pengoksidasi roket; konsumsi LOX tergantung pada aktivitas program ruang angkasa. Oksigen murni digunakan dalam kapal selam dan lonceng menyelam.
Oksigen komersial atau udara yang diperkaya oksigen telah menggantikan udara biasa dalam industri kimia untuk pembuatan bahan kimia seperti oksidasi yang dikendalikan sebagai asetilen, etilen oksida, dan metanol. Aplikasi medis oksigen termasuk penggunaan di tents oksigen, inhalators, dan inkubator anak. Anestesi gas kaya oksigen memastikan dukungan hidup selama anestesi umum. Oksigen sangat penting dalam sejumlah industri yang menggunakan kiln.
Sifat Kimia dan Reaksi Oksigen
Nilai besar elektronegativitas dan afinitas elektron unsur oksigen yang khas menunjukkan perilaku non logam. Dalam semua senyawanya, oksigen mengasumsikan keadaan oksidasi negatif seperti yang diharapkan dari dua orbital luar setengah penuh. Ketika orbital ini diisi oleh transfer elektron, oksida ion O2 dibuat. Dalam peroksida (spesies yang berisi ion O22-) diasumsikan bahwa setiap oksigen memiliki muatan -1. Oksigen menerima elektron dengan transfer lengkap atau sebagian mendefinisikannya sebagai agen pengoksidasi. Ketika agen tersebut bereaksi dengan zat penyumbang elektron, tingkat oksidasi oksigen akan diturunkan. Perubahan (menurunkan), dari nol ke bentuk -2 dalam kasus oksigen, disebut pengurangan. Oksigen dapat dianggap sebagai zat pengoksidasi "asli", nomenklatur digunakan untuk menggambarkan oksidasi dan reduksi yang berbasis pada perilaku khas oksigen ini.
Seperti dijelaskan dalam bagian tentang allotropy, oksigen membentuk spesies diatomik, O2, dalam kondisi normal, dan juga spesies triatomik ozon, O3. Ada beberapa bukti bahwa spesies tetratomic sangat tidak stabil, O4. Dalam bentuk diatomik molekul ada dua elektron tidak berpasangan yang terletak pada orbital anti. Perilaku paramagnetik oksigen menegaskan kehadiran elektron tersebut.
Reaktivitas intens ozon kadang-kadang dijelaskan dengan menyatakan bahwa salah satu dari tiga atom oksigen dalam "atom"; dipisahkan dari molekul O3, dan menjadi molekul oksigen.
Spesies molekuler, O2, tidak terlalu reaktif pada suhu dan tekanan normal (ambient). Spesies atom, O, jauh lebih reaktif. Energi disosiasi (O2 → 2O) besarnya 117,2 kilokalori per mol.
Oksigen memiliki keadaan oksidasi -2 di sebagian besar senyawanya. Membentuk berbagai macam senyawa kovalen, di antaranya adalah oksida non logam, seperti air (H2O), sulfur dioksida (SO2), dan karbon dioksida (CO2); senyawa organik seperti alkohol, aldehida, dan asam karboksilat; asam umum seperti sulfat (H2SO4), karbonat (H2CO3), dan nitrat (HNO3); dan garam yang sesuai, seperti natrium sulfat (Na2SO4), natrium karbonat (Na2CO3), dan natrium nitrat (NaNO3). Oksigen hadir sebagai ion oksida, O2, dalam struktur kristal oksida logam padat seperti kalsium oksida, CaO. Logam Superoksida, seperti kalium superoksida, KO2, mengandung ion O2, sedangkan logam peroksida, seperti barium peroksida, BaO2, mengandung ion O22-.
Robert C. Brasted
Properti elemen
|
nomor atom
|
8
|
berat atom
|
15,9994
|
titik lebur
|
-218,4 ° C (-361,1 ° F)
|
titik didih
|
-183,0 ° C (-297,4 ° F)
|
density
|
(1 atm, 0 ° C) 1,429 g / liter
|
bentuk oksidasi
|
-1, -2, +2 (senyawa dengan fluor)
|
elektron konfigurasi.
| 1s22s22p4 |
Next page:
1
2
3