Penggunaan Sulfur
Sulfur begitu banyak digunakan dalam proses industri yang
konsumsinya sering dihubungkan sebagai indikator yang kegiatan industri dan
keadaan ekonomi nasional. Sekitar enam dari tujuh sulfur yang dihasilkan diubah
menjadi asam sulfat, dimana penggunaan tunggal terbesar adalah dalam pembuatan
pupuk (fosfat dan amonium sulfat). Kegunaan penting lainnya termasuk produksi
pigmen, deterjen, serat, produk minyak bumi, lembaran logam, bahan peledak, dan
penyimpanan baterai; dan ratusan aplikasi lain yang dikenal. Sulfur yang tidak
dikonversi ke asam sulfat digunakan dalam pembuatan kertas, insektisida,
fungisida, zat warna, dan berbagai produk lainnya.
Senyawa Sulfur
Bentuk senyawa Sulfur dalam bilangan oksidasi -2 (sulfida, S2-),
+4 (sulfit, SO32-), dan +6 (sulfat, SO42-).
Ini dapat bergabung dengan hampir semua elemen. Fitur yang tidak biasa dari
beberapa senyawa belerang merupakan fakta bahwa sulfur adalah unsur kedua terbanya
36+setelah karbon dalam menunjukkan catenation-yaitu, ikatan atom ke atom lain
yang identik. Hal ini memungkinkan atom belerang membentuk sistem cincin dan
struktur rantai. Signifikansi senyawa sulfur dan kelompok senyawa adalah sebagai
berikut.
1.
Salah satu senyawa sulfur yang paling sering
dijumpai adalah hidrogen sulfida, yang juga dikenal sebagai hidrogen
sulfureted, atau stinkdamp, H2S, yang tidak berwarna, sangat beracun
dan berbau khas telur busuk. Hal ini diproduksi secara alami oleh peluruhan zat
organik yang mengandung sulfur dan sering hadir dalam uap dari gunung berapi
dan air mineral. Sejumlah besar hidrogen sulfida diperoleh dalam penghapusan
sulfur dari minyak bumi. Dahulu sulfur digunakan secara ekstensif di
laboratorium kimia sebagai pereaksi analitis.
2.
Semua logam kecuali emas dan platinum bergabung
dengan sulfur untuk membentuk sulfida anorganik. Sulfida seperti senyawa ion
yang mengandung ion S2- sulfida bermuatan negatif; senyawa ini dapat
dianggap sebagai garam dari hidrogen sulfida. Bijih sulfida anorganik merupakan
bagian penting dari logam seperti besi, nikel, tembaga, kobalt, seng, dan
timah.
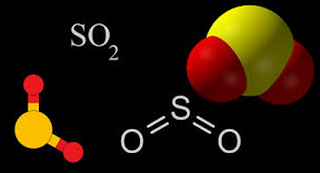
3.
Beberapa oksida dibentuk oleh sulfur dan
oksigen; yang paling penting adalah gas belerang dioksida SO2 yang berat,
tidak berwarna, beracun. Hal ini digunakan terutama sebagai prekursor sulfur
trioksida, SO3, dan dari situ asam sulfat, H2SO4
dibuat. Hal ini juga digunakan sebagai pemutih dan zat pereduksi industri.
Aplikasi penting lainnya termasuk penggunaannya dalam pengawetan makanan dan
untuk pematangan buah. (Lihat juga sulfur oksida.)
4.
Sulfur membentuk berbagai senyawa dengan
unsur-unsur halogen. Dalam kombinasi dengan klorin menghasilkan sulfur klorida
seperti disulfur diklorida, S2Cl2, suatu cairan kuning
keemasan korosif yang digunakan dalam pembuatan produk kimia. Bereaksi dengan
etilen untuk menghasilkan gas mustard, dan dengan asam tak jenuh yang berasal
dari lemak membentuk produk berminyak yang merupakan komponen dasar pelumas.
Dengan fluor, sulfur membentuk sulfur fluorida, yang paling berguna dari sulfur
fluoride adalah sulfur heksafluorida, SF6, gas yang digunakan
sebagai insulator dalam berbagai perangkat listrik. Sulfur juga membentuk
oxyhalides, di mana atom belerang terikat pada oksigen dan atom halogen. Ketika
senyawa tersebut diberi nama thionyl, yang istilahnya digunakan untuk menunjuk sesuatu
yang mengandung unit SO dan sulfuryl, istilah untuk senyawa dengan SO2.
Klorida tionil, SOCl2, cairan yang bersifat beracun, menguap yang
digunakan dalam proses kimia organik untuk mengubah asam karboksilat dan
alkohol menjadi senyawa yang mengandung klorin. Sulfuryl klorida, SO2Cl2,
adalah cairan fisik dengan sifat serupa yang digunakan dalam pembuatan
senyawa-senyawa tertentu yang mengandung sulfur, klorin, atau keduanya.